|
| |
|

Ciência que põe os átomos em desordem
Professor ensina sobre física
dos materiais a partir de tese de doutorado envolvendo
diamante e silício
LUIZ
SUGIMOTO
 |
|
O professor Alex Antonelli, do Instituto de Física
“Gleb Wataghin” (IFGW) da Unicamp: “imperfeições
complicadas” |
Perfeito, nem diamante. Composto
basicamente por átomos de carbono, o diamante
traz cada átomo ligado a outros quatro vizinhos,
numa estrutura harmonicamente coesa, rígida
e tridimensional, que lhe rende toda a transparência
e a qualidade de elemento mais duro encontrado na
natureza. Alguns tipos de diamante, porém,
apresentam deformações, como camadas
em que um átomo pode estar ligado a apenas
três vizinhos. Esta camada defeituosa possui
a estrutura do grafite, primo pobre do diamante, igualmente
composto por carbono mas de uma fragilidade que se
sente ao apontar um lápis.
Perfeito também parece ser
um vaso de cristal da região da Bohemia, mas
apenas a olho nu. Aos olhos da física, esses
cristais não passam de vidro fabricado com
esmero, apresentando as mesmas imperfeições
de um vidro de janela, cheio de bolhinhas de ar e
de átomos desconjuntados que formam uma estrutura
amassada. “Cristal, para nós, é
o diamante, o rubi, a esmeralda. Em relação
a eles, o vidro é o oposto em termos de ordem
atômica. A maneira como os átomos estão
agrupados é que determina as propriedades de
um material. Conhecendo como os átomos estão
arranjados, compreendemos coisas que estão
bem próximas”, ensina o professor Alex
Antonelli, do Instituto de Física “Gleb
Wataghin” (IFGW) da Unicamp.
O professor foi convidado a comentar
a tese de doutorado de seu orientado Caetano Rodrigues
Miranda: Da Ordem à Desordem: uma visão
da ciência dos materiais computacional, defendida
em meados de setembro junto ao IFGW. “Caetano
encontra-se em Trieste (Itália), usufruindo
uma bolsa de pós-doutorado concedida por um
conceituado centro internacional de física
teórica, em boa parte graças a este
trabalho. É uma tese densa em informações
de primeira linha, a respeito de cinco projetos em
que ele esteve envolvido”, justifica Antonelli.
Dois desses projetos são destacados mais à
frente. Antes, o pesquisador discorreu sobre a ciência
dos materiais.
“Da ordem à desordem”
é um título que serviria como lema dos
pesquisadores do Departamento de Física de
Materiais Condensados. Para eles, imperfeição
não significa, necessariamente, inutilidade
de uma estrutura atômica. No esforço
para compreender as propriedades dos materiais, rotineiramente
se simula uma desordem dos átomos, “deformando”
a estrutura para encontrar novas aplicações.
“Somente no início do século 20
é que surgiu o entendimento de como os átomos
se encontram estruturados. Nos anos 1930 foi possível
entender porque o metal é maleável,
permitindo o molde de estruturas ou carrocerias de
automóvel, enquanto o vidro não oferecia
este recurso porque quebrava”, lembra.
 Semicondutores
– Antonelli afirma que, no caso dos metais, pode-se
criar “imperfeições complicadas”,
envolvendo toda uma camada de átomos, a fim
de que esta corra sobre outros átomos ao invés
de quebrar. Mas são os semicondutores, essenciais
para a indústria eletrônica, um dos objetos
principais de pesquisa no departamento. O silício
seria um condutor pobre de eletricidade em relação
ao cobre e prata, mas os pesquisadores injetam “impurezas”
em sua estrutura, substituindo, por exemplo, um átomo
de silício por um átomo de fósforo
ou boro, atribuindo-lhe propriedades elétricas.
Esta pitada de outro elemento no silício é
que permite a fabricação de dispositivos
eletrônicos como os transistores. Semicondutores
– Antonelli afirma que, no caso dos metais, pode-se
criar “imperfeições complicadas”,
envolvendo toda uma camada de átomos, a fim
de que esta corra sobre outros átomos ao invés
de quebrar. Mas são os semicondutores, essenciais
para a indústria eletrônica, um dos objetos
principais de pesquisa no departamento. O silício
seria um condutor pobre de eletricidade em relação
ao cobre e prata, mas os pesquisadores injetam “impurezas”
em sua estrutura, substituindo, por exemplo, um átomo
de silício por um átomo de fósforo
ou boro, atribuindo-lhe propriedades elétricas.
Esta pitada de outro elemento no silício é
que permite a fabricação de dispositivos
eletrônicos como os transistores.
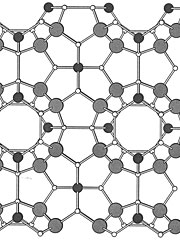
No clatrato de silício, a
estrutura atômica forma figuras parecidas com
gaiolas. Nos espaços vazios, pesquisadores
colocam átomos de bário, buscando propriedades
termoelétricas para o material, que pode funcionar
como micro-refrigerador, eliminando uma grande limitação
dos dispositivos eletrônicos: o calor que geram.
Os cientistas também estão “amarrotando”
a estrutura atômica do silício, como
se fosse vidro, visando à criação
de células que convertam a luz do sol diretamente
em energia elétrica – diferentemente de
um coletor solar, que apenas capta e transfere o calor
do sol para a água do chuveiro.
|
A física dos líquidos
Há propriedades do
diamante ainda pouco compreendidas. Alguns desses
cristais têm a coloração
alterada, tendendo para o marrom, tornando-se
menos transparentes. É uma imperfeição
na estrutura que atinge toda uma camada de átomos
de carbono, podendo mudar suas propriedades,
eventualmente a resistência. Chama-se
tais camadas de plaquetas. “É senso
comum que esses diamantes, durante o processo
de formação, acabam contaminados
com nitrogênio – elemento comum encontrado
no ar junto com o oxigênio. As controvérsias
estão nas explicações sobre
a deformação que ocorre na estrutura
atômica”, afirma o professor Alex
Antonelli.
A tese de Caetano Rodrigues
Miranda tem o mérito de apresentar mais
uma hipótese para a literatura. Depois
de realizar as simulações computacionais,
o autor sugere que a estrutura perfeita do diamante,
com cada átomo de carbono se ligando
a outros quatro, é quebrada pelas plaquetas
porque nelas um átomo se liga a somente
três vizinhos, como ocorre no grafite.
“No processo de formação
do diamante, podemos imaginar uma plaqueta correndo
sobre a outra, uma para trás e outra
para a frente. Temos um cristal perfeito pela
visão lateral, mas defeituoso e comprometendo
sua transparência no nível intermediário”,
ilustra o professor, recorrendo a um pequeno
modelo de plástico da estrutura atômica.
Suas explicações, contudo, terminam
aí: “Ainda estamos na fase de redação
dos resultados, a fim de submeter o artigo a
uma publicação científica.
Não podemos antecipar muitos detalhes”,
pondera.
Outro trabalho de Caetano
Miranda é a simulação do
comportamento do silício em estado líquido.
Segundo Antonelli, a reação é
similar à da água. “Conforme
baixamos a temperatura da água, sua densidade
vai aumentando e o volume diminuindo. O menor
volume é registrado a 4ºC. Mas continuando
o resfriamento, a densidade diminui e o volume
volta a crescer. A garrafa no congelador quebra
porque o volume do gelo é maior que o
da água em estado líquido. Poucos
elementos da natureza têm esta propriedade
de decrescer em volume e depois voltar a crescer.
E o mesmo ocorre com o silício”,
observa.
A fusão do silício
ocorre a 1955ºC. Miranda observou as alterações
que acontecem nas propriedades do material na
faixa entre 3000ºC e 600ºC, com resfriamentos
bruscos ou graduais, uma experiência impossível
de ser executada em laboratório. “Existe
a hipótese de que o silício, quando
resfriado rapidamente, pode permanecer em estado
líquido mesmo abaixo dos 1955ºC.
Tal qual uma cerveja que resfriamos às
pressas no freezer: ela permanece líquida
mesmo a 0º, mas congela imediatamente quando
abrimos a garrafa ou a chacoalhamos”, exemplifica.
Existem, então, dois tipos de líquido,
um mais denso e com volume menor, e outro menos
denso com volume maior e que vem antes do processo
de vitrificação (congelamento).
Desconhecidos –
“Já se consegue produzir o vidro
de água, por meio de um resfriamento
extremamente rápido – a água
não vira gelo com sua estrutura bonitinha,
mas vidro com sua estrutura bagunçada.
O que remete ao silício amorfo que mencionei.
Ainda não é possível obtê-lo
através do resfriamento, mas isso pode
ajudar a entender porque líquidos aparentemente
tão diferentes, como água e silício,
apresentam tantas semelhanças. Quase
todo mundo já esqueceu uma garrafa de
cerveja no congelador e teve uma desagradável
surpresa”, brinca o professor Alex Antonelli.
Caetano Miranda, em sua tese,
também abordou o silício amorfo
e sua utilização para transformação
da luz solar em eletricidade. Sua eficiência
é limitada por uma degradação
das propriedades do material devido à
própria luz que o faz funcionar. Miranda
indica que a existência de defeitos nesta
forma de silício “amarrotado”
talvez estejam ligados à perda de eficiência
das células solares.
|
|
|
|






 Semicondutores
– Antonelli afirma que, no caso dos metais, pode-se
criar “imperfeições complicadas”,
envolvendo toda uma camada de átomos, a fim
de que esta corra sobre outros átomos ao invés
de quebrar. Mas são os semicondutores, essenciais
para a indústria eletrônica, um dos objetos
principais de pesquisa no departamento. O silício
seria um condutor pobre de eletricidade em relação
ao cobre e prata, mas os pesquisadores injetam “impurezas”
em sua estrutura, substituindo, por exemplo, um átomo
de silício por um átomo de fósforo
ou boro, atribuindo-lhe propriedades elétricas.
Esta pitada de outro elemento no silício é
que permite a fabricação de dispositivos
eletrônicos como os transistores.
Semicondutores
– Antonelli afirma que, no caso dos metais, pode-se
criar “imperfeições complicadas”,
envolvendo toda uma camada de átomos, a fim
de que esta corra sobre outros átomos ao invés
de quebrar. Mas são os semicondutores, essenciais
para a indústria eletrônica, um dos objetos
principais de pesquisa no departamento. O silício
seria um condutor pobre de eletricidade em relação
ao cobre e prata, mas os pesquisadores injetam “impurezas”
em sua estrutura, substituindo, por exemplo, um átomo
de silício por um átomo de fósforo
ou boro, atribuindo-lhe propriedades elétricas.
Esta pitada de outro elemento no silício é
que permite a fabricação de dispositivos
eletrônicos como os transistores.