|

Na busca do sólido superduro,
pesquisadores do IFGW juntam a física teórica à experimental
Mais duro que o diamante
LUIZ SUGIMOTO
Enquanto o grafite é um sólido opaco e quebradiço, o diamante é transparente e o mais duro material encontrado na natureza. Tamanha diferença faz parecer estranho que ambos sejam formados apenas por carbono. Foi a partir do grande conhecimento desses materiais que cientistas da Universidade da Califórnia, em Berkeley, previram teoricamente a existência de um composto de dureza comparável, ou até maior, que à da pedra tão preciosa em colares quanto em aplicações tecnológicas. mais duro material encontrado na natureza. Tamanha diferença faz parecer estranho que ambos sejam formados apenas por carbono. Foi a partir do grande conhecimento desses materiais que cientistas da Universidade da Califórnia, em Berkeley, previram teoricamente a existência de um composto de dureza comparável, ou até maior, que à da pedra tão preciosa em colares quanto em aplicações tecnológicas.
Estudos teóricos e experimentais na direção de sintetizar este sólido superduro envolveram os professores Maria Cristina dos Santos e Fernando Alvarez, do Instituto de Física Gleb Wataghin (IFGW) da Unicamp. Eles assinam artigo descrevendo fulerenos modificados, contendo nitrogênio, publicado em janeiro na conceituada Physical Review Letters. O resultado da pesquisa foi destacado pelo editor do portal da Nature Materials, Philip Ball, porque sugere a existência de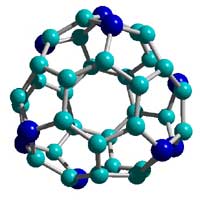 compostos da família do fulereno - uma bolinha de nome engraçado e que no fundo nos remete ao futebol, como veremos mais adiante. compostos da família do fulereno - uma bolinha de nome engraçado e que no fundo nos remete ao futebol, como veremos mais adiante.
A pesquisadora Maria Cristina recorda que, no início da década de 1970, os cientistas já teorizavam sobre a existência de formas moleculares de carbono puro. Em 1985, o britânico Harold Kroto e os americanos Robert Curl Jr. e Richard Smalley descobriram os fulerenos, de propriedades peculiares, como a de se obter através deles o diamante sintético quando submetidos a pressões adequadas. Entre as várias formas moleculares observadas está o C60: um poliedro, quase uma bola perfeita, a molécula de maior simetria já descoberta. Os três cientistas ganharam o Nobel de Química por isso, em 1996.
Os presidiários que costuram bolas de futebol, trocando dias de condenação por dias de trabalho, sabem que o formato de uma bola exige, necessariamente, 32 gomos de couro: 12 com cinco lados (pentágonos) e 20 com seis lados (hexágonos). É a mesma estrutura do fulereno C60, nome escolhido para homenagear o americano Richard Buckminster Fuller (1895-1983). Arquiteto, designer e inventor, Fuller criou a estrutura arquitetônica mais leve e barata já projetada, uma cúpula geodésica empregando triângulos e formando um belo domo. Com ela, pretendia cobrir Manhattan e guardar a energia do sol para aquecer a ilha durante todo o inverno. Buckminster fullerene é a denominação científica da molécula de C60. E, como Bucky era o apelido do arquiteto, a bolinha é também chamada de buckyball.
Fuligem - Os fulerenos foram encontrados em fuligem. "Quando se vaporizam eletrodos de grafite em uma descarga em arco, dentro de uma câmara fechada contendo o gás hélio, forma-se uma fuligem de carbono. Esta fuligem, depositada nas paredes da câmara, contém aproximadamente 10% de fulerenos", explica Maria Cristina. Uma análise por espectroscopia de massa permite estabelecer a relação entre a carga (ganho ou perda de elétrons) e a massa das partículas dessa fuligem.
O gráfico representando o número de partículas observadas em função da relação massa/carga mostra a grande variedade de partículas que podem ser formadas. "Mas vê-se um pico muito acentuado, de 720 unidades de massa atômica, o que corresponde a 60 átomos de carbono. Já se colocava, na década de 1970, a hipótese de que existiria um tipo de estrutura molecular envolvendo 60 átomos de carbono, a estrutura de hexágonos e pentágonos que formava um esferóide perfeito, uma bola de futebol", ilustra a pesquisadora.
Era preciso extrair aquela molécula em particular e descobriu-se que ela se dissolvia em tolueno. Mergulhadas as partículas de fuligem em tolueno, retirou-se a parte não dissolvida, colocando-se a solução que restou para secar: "E da solução surgiram cristaizinhos, as bolinhas perfeitas, especificadas como C60", conta Maria Cristina.
Nitrogênio - Na Unicamp, a história do fulereno ganhou novo viés com o professor Fernando Alvarez, interessado em encontrar meios de produzir o sólido previsto teoricamente e que apresentaria propriedades muito interessantes, como a de ser muito duro. Sua fórmula é C3N4 - nitreto de carbono - ou seja: a unidade básica do sólido contém quatro nitrogênios para cada três carbonos, ligados numa rede tridimensional -C-N-. "Ocorre que o tipo de ligação química entre o nitrogênio e o carbono nesse sólido é difícil de se reproduzir, pois ambos os átomos tendem a fazer ligações múltiplas. É uma ligação meio exótica", admite Maria Cristina, uma teórica da física, que atendeu à proposta de parceria de Alvarez, um físico experimental, para realizar cálculos de modelagem molecular.
Idéia exótica, mas quem sabe, viável, visto que já existe um sólido equivalente, feito de silício e nitrogênio (nitreto de silício, Si3N4). Como o silício é da mesma família química do carbono, muitos cientistas no mundo se fecharam em laboratórios, usando rotas de síntese semelhantes às empregadas para produzir nitreto de silício, atrás da fórmula para sintetizar o material superduro.
Fernando Alvarez é um desses cientistas do grupo do Laboratório de Pesquisas Fotovoltaicas do IFGW. O material que ele obtinha, depositado por bombardeio de grafite por íons de nitrogênio, era um filme amorfo, mas medidas de espectroscopia indicaram que havia uma parte do nitrogênio ligado a carbono na forma predita para o nitreto de carbono. "Em seus cálculos, Maria Cristina observou que nosso material poderia estar formando "folhas" que se curvavam. Então, surgiu a idéia de que elas poderiam se fechar em esferóide. Talvez estivéssemos frente a outro tipo de fulereno, contendo nitrogênio e carbono", lembra o professor.
Os pequenos - Os cálculos para ver se as folhas se fechavam resultaram, no computador, em uma gaiola com ligações químicas semelhantes às do sonhado sólido superduro, com 56 átomos, 24 carbonos e 32 nitrogênios, e o mesmo número de elétrons de valência do C60. Esta coincidência de elétrons indica que a molécula C24N32 = 8(C3N4) é parecida, do ponto de vista de estabilidade, com o C60. Uma constatação nova, que já valeria todo o trabalho, e que mereceu sua publicação. "Mas o professor Alvarez sugeriu que tentássemos produzir essa bolinha experimentalmente", diz Maria Cristina, agora com a colaboração importante do doutorando do IFGW Roosevelt Droppa Jr. e do graduando do ITA Daniel Schultz, que também assinam o artigo no Physical Review Letters.
Para a deposição da fuligem com eletrodos de grafite, substituiu-se o gás hélio por uma mistura de hélio e nitrogênio. "Ao contrário do hélio, o nitrogênio não é inerte, ele se liga ao carbono. A mistura poderia substituir alguns carbonos por nitrogênio e gerar a bolinha", explica a professora. De fato, na análise da fuligem por espectroscopia de massa, surgiu uma estrutura de intensidade muito grande em comparação às demais, com exatamente a metade da massa do C24N32 = 8(C3N4). Outras estruturas de massas entre 480 e 600 unidades atômicas de massa apareceram no espectro. A análise detalhada desse espectro sugeria a existência de fulerenos contendo entre 40 e 50 átomos, mas com alguns átomos de carbono substituídos por nitrogênio.
Esses fulerenos menores possuem 12 pentágonos e um número variável de hexágonos, sempre menor do que 20. Com isso, alguns pentágonos aparecem lado a lado, diminuindo a estabilidade da estrutura. Cálculos quânticos demonstraram que, para estabilizar a estrutura dos fuleneros menores, é conveniente trocar alguns carbonos por nitrogênios, especialmente nos pentágonos, para diminuir a tensão das ligações químicas. "É um caminho difícil, pois mesmo que se encontre um solvente para extrair a nova bolinha, tanto trabalho talvez resulte em quantidades ínfimas (microgramas) do material", comenta Alvarez. "Ainda temos muita química e muito trabalho pela frente", admite Maria Cristina.
| Teoria na prática
A teórica Maria Cristina dos Santos e o experimental Fernando Alvarez aproveitam a boa repercussão de sua pesquisa para ressaltar o valor da colaboração entre teóricos e experimentais. "No terceiro mundo, alimenta-se uma dicotomia entre os físicos teóricos e os experimentais. Nos países desenvolvidos, há uma demanda dos experimentais pelos teóricos e vice-versa, o que se traduz em uma riqueza enorme de resultados", observa Alvarez.
"Se com o professor Alvarez pensamos modelos teóricos para verificar certas hipóteses, eu posso fazer cálculos e pedir-lhe que realize medições ou prepare experimentos. Com essa colaboração, a pesquisa anda mais rapidamente e por caminhos mais interessantes", concorda Maria Cristina. A pesquisa em parceria, segundo eles, talvez já sirva para abrir uma nova física de pequenas moléculas. Os trabalhos foram viabilizados com apoio do IFGW, da Fapesp e do CNPq.
|
|





 mais duro material encontrado na natureza. Tamanha diferença faz parecer estranho que ambos sejam formados apenas por carbono. Foi a partir do grande conhecimento desses materiais que cientistas da Universidade da Califórnia, em Berkeley, previram teoricamente a existência de um composto de dureza comparável, ou até maior, que à da pedra tão preciosa em colares quanto em aplicações tecnológicas.
mais duro material encontrado na natureza. Tamanha diferença faz parecer estranho que ambos sejam formados apenas por carbono. Foi a partir do grande conhecimento desses materiais que cientistas da Universidade da Califórnia, em Berkeley, previram teoricamente a existência de um composto de dureza comparável, ou até maior, que à da pedra tão preciosa em colares quanto em aplicações tecnológicas. compostos da família do fulereno - uma bolinha de nome engraçado e que no fundo nos remete ao futebol, como veremos mais adiante.
compostos da família do fulereno - uma bolinha de nome engraçado e que no fundo nos remete ao futebol, como veremos mais adiante.