MANUEL ELVES FILHO
 Dois estudos teóricos conduzidos por professores do Instituto de Física Gleb Wataghin (IFGW) da Unicamp acabam de trazer novas contribuições para o entendimento das propriedades do gelo. As pesquisas, que contaram com a colaboração de cientistas da USP, valeram-se de modelos realísticos criados a partir da física computacional. Graças a esse recurso tecnológico, os pesquisadores fizeram simulações que geraram dados complementares àqueles obtidos em experimentos práticos, alguns realizados há dezenas de anos. Os trabalhos foram publicados numa das mais prestigiosas revistas científicas internacionais, a “Physical Review Letters”.
Dois estudos teóricos conduzidos por professores do Instituto de Física Gleb Wataghin (IFGW) da Unicamp acabam de trazer novas contribuições para o entendimento das propriedades do gelo. As pesquisas, que contaram com a colaboração de cientistas da USP, valeram-se de modelos realísticos criados a partir da física computacional. Graças a esse recurso tecnológico, os pesquisadores fizeram simulações que geraram dados complementares àqueles obtidos em experimentos práticos, alguns realizados há dezenas de anos. Os trabalhos foram publicados numa das mais prestigiosas revistas científicas internacionais, a “Physical Review Letters”.
Mas por que é tão importante estudar as propriedades do gelo? A resposta é simples. Descobrindo um pouco mais sobre a estrutura desse cristal, a ciência também estará ampliando o seu conhecimento acerca da água, recurso indispensável para a vida. Nunca é demais lembrar que gelo é água em estado sólido. Além disso, a maior parte de água presente no universo encontra-se nessa forma. “O gelo compõe, por exemplo, a maioria dos cometas. Na Terra, as geleiras concorrem para o equilíbrio do clima do planeta”, explica um dos autores dos estudos, o professor Alex Antonelli, do IFGW. De acordo com ele, que trabalhou em conjunto com o colega Maurice de Koning, as pesquisas concentraram-se na fase mais comum do gelo, classificada de Ih, a mesma produzida pela geladeira doméstica.
Antonelli afirma que não existem cristais perfeitos na natureza, entre eles o gelo. Todos apresentam defeitos. São eles que conferem certas propriedades a esses sólidos. Estudando tais imperfeições, os cientistas podem, portanto, aprender um pouco mais sobre as características dos materiais cristalinos. No caso em questão, os pesquisadores da Unicamp investigaram inicialmente dois defeitos pontuais. O primeiro é denominado vacância e o segundo, interstício. Ambos têm a ver com a ligação de hidrogênio entre as moléculas da água, constituídas por dois átomos de hidrogênio e um de oxigênio (H2O).
As moléculas da água, diz de Koning, ficam agrupadas e ocupam posições bem definidas. Mesmo em estado sólido, a regularidade se mantém. Simplificando, as moléculas formam uma rede composta por hexágonos, que se apresentam da seguinte forma: há sempre um átomo de hidrogênio entre dois de oxigênio, enquanto um átomo de oxigênio invariavelmente intercala dois de hidrogênio de moléculas distintas. Ocorre, porém, que testes realizados no Japão em 1982 aventaram a hipótese de que, dependendo da temperatura, os defeitos pontuais poderiam surgir em maior ou menor grau.
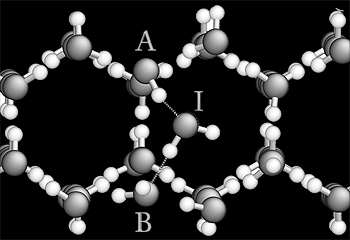 Simulações – Com o auxílio da mecânica quântica e de métodos da física computacional, os cientistas do IFGW produziram simulações realísticas que ratificaram a conjectura. De acordo com Antonelli, quanto mais próximo do ponto de fusão (zero grau Celsius), maior a quantidade de moléculas intersticiais. Em outras palavras, as ligações hexagonais apresentam elementos intrusos na rede cristalina. Abaixo de 43 graus Celsius negativos, o defeito mais comum é a vacância, ou seja, a falta de uma molécula de água. “Esse mecanismo é um indício de que a matéria pode se mover dentro do cristal. Dito de outro modo, existe a possibilidade de que uma molécula ocupe o lugar da sua vizinha, como se fosse um jogo de sinuca, no qual uma bola empurra a outra”, exemplifica o docente do IFGW.
Simulações – Com o auxílio da mecânica quântica e de métodos da física computacional, os cientistas do IFGW produziram simulações realísticas que ratificaram a conjectura. De acordo com Antonelli, quanto mais próximo do ponto de fusão (zero grau Celsius), maior a quantidade de moléculas intersticiais. Em outras palavras, as ligações hexagonais apresentam elementos intrusos na rede cristalina. Abaixo de 43 graus Celsius negativos, o defeito mais comum é a vacância, ou seja, a falta de uma molécula de água. “Esse mecanismo é um indício de que a matéria pode se mover dentro do cristal. Dito de outro modo, existe a possibilidade de que uma molécula ocupe o lugar da sua vizinha, como se fosse um jogo de sinuca, no qual uma bola empurra a outra”, exemplifica o docente do IFGW.
Ainda em relação ao defeito intersticial, os pesquisadores da Unicamp descobriram que a molécula de água intrusa apresenta estruturas distintas. Elas podem ou não estar ligadas às redes hexagonais. “Para chegar a esses resultados, nós consumimos vários meses de cálculos, realizados por computadores de alto desempenho. Há dez anos, isso não seria possível, pois não havia tecnologia disponível’, afirma de Koning.
O segundo estudo conduzido pelos docentes do IFGW investigou o defeito Bjerrum, que leva este nome em referência ao físico dinamarquês Niels Bjerrum. Ele propôs em 1952, baseado em experimentos realizados pelo físico holandês Peter Debye, que o gelo deveria apresentar falhas que permitiriam às moléculas de água se ordenarem a partir da exposição a um campo elétrico. Por meio das simulações em computador, os pesquisadores da Unicamp levantaram evidências de que tal premissa também está correta. De acordo com de Koning, cada molécula de água cede duas e recebe igualmente duas ligações de suas vizinhas, o que completa a formação.
 Assim, um próton de hidrogênio encontra-se sempre entre dois átomos de oxigênio. Entretanto, quando submetidas a um campo elétrico, as moléculas assumem uma outra ordem. A estrutura muda e passa a ter a seguinte configuração: enquanto numa ligação aparecem dois prótons de hidrogênio entre dois átomos de oxigênio, numa outra ocorre um vazio. “As moléculas fazem um movimento de rotação”, esclarece Antonelli. Experimentalmente, esse defeito pode ser criado, por exemplo, com o acréscimo de um ácido ao gelo. Ocorre, porém, que o próprio mecanismo que gera a falha pode interferir no seu resultado. É por isso as simulações são importantes, porque permitem uma interpretação do fenômeno mais próxima do real. “Não se trata de dizer que a teoria é melhor ou mais eficiente do que o experimento prático. Os dois são importantes justamente porque se complementam”, analisa Antonelli.
Assim, um próton de hidrogênio encontra-se sempre entre dois átomos de oxigênio. Entretanto, quando submetidas a um campo elétrico, as moléculas assumem uma outra ordem. A estrutura muda e passa a ter a seguinte configuração: enquanto numa ligação aparecem dois prótons de hidrogênio entre dois átomos de oxigênio, numa outra ocorre um vazio. “As moléculas fazem um movimento de rotação”, esclarece Antonelli. Experimentalmente, esse defeito pode ser criado, por exemplo, com o acréscimo de um ácido ao gelo. Ocorre, porém, que o próprio mecanismo que gera a falha pode interferir no seu resultado. É por isso as simulações são importantes, porque permitem uma interpretação do fenômeno mais próxima do real. “Não se trata de dizer que a teoria é melhor ou mais eficiente do que o experimento prático. Os dois são importantes justamente porque se complementam”, analisa Antonelli.
Outra contribuição dos pesquisadores da Unicamp para a melhor compreensão do defeito Bjerrum diz respeito à quantidade de energia necessária para gerá-lo. De Koning criou virtualmente uma rede cristalina na qual os anéis hexagonais se repetiam 16 vezes. Em seguida, girou artificialmente a posição de um átomo de hidrogênio, estabelecendo assim a falha. Após inúmeros cálculos complexos, o pesquisador concluiu que a energia necessária para torcer uma ligação de hidrogênio é até 73% maior do que se estimava. Ao mesmo tempo, a energia empregada para que a torção passe de uma molécula para outra pode ser até 63% mais baixa. “Esses números indicam que de fato existem armadilhas que aprisionam os defeitos e os impedem de prosseguir”. Além de Antonelli e de Koning, participaram das pesquisas os físicos Adalberto Fazzio e Antônio José Roque da Silva, ambos da USP.





 Dois estudos teóricos conduzidos por professores do Instituto de Física Gleb Wataghin (IFGW) da Unicamp acabam de trazer novas contribuições para o entendimento das propriedades do gelo. As pesquisas, que contaram com a colaboração de cientistas da USP, valeram-se de modelos realísticos criados a partir da física computacional. Graças a esse recurso tecnológico, os pesquisadores fizeram simulações que geraram dados complementares àqueles obtidos em experimentos práticos, alguns realizados há dezenas de anos. Os trabalhos foram publicados numa das mais prestigiosas revistas científicas internacionais, a “Physical Review Letters”.
Dois estudos teóricos conduzidos por professores do Instituto de Física Gleb Wataghin (IFGW) da Unicamp acabam de trazer novas contribuições para o entendimento das propriedades do gelo. As pesquisas, que contaram com a colaboração de cientistas da USP, valeram-se de modelos realísticos criados a partir da física computacional. Graças a esse recurso tecnológico, os pesquisadores fizeram simulações que geraram dados complementares àqueles obtidos em experimentos práticos, alguns realizados há dezenas de anos. Os trabalhos foram publicados numa das mais prestigiosas revistas científicas internacionais, a “Physical Review Letters”. Simulações – Com o auxílio da mecânica quântica e de métodos da física computacional, os cientistas do IFGW produziram simulações realísticas que ratificaram a conjectura. De acordo com Antonelli, quanto mais próximo do ponto de fusão (zero grau Celsius), maior a quantidade de moléculas intersticiais. Em outras palavras, as ligações hexagonais apresentam elementos intrusos na rede cristalina. Abaixo de 43 graus Celsius negativos, o defeito mais comum é a vacância, ou seja, a falta de uma molécula de água. “Esse mecanismo é um indício de que a matéria pode se mover dentro do cristal. Dito de outro modo, existe a possibilidade de que uma molécula ocupe o lugar da sua vizinha, como se fosse um jogo de sinuca, no qual uma bola empurra a outra”, exemplifica o docente do IFGW.
Simulações – Com o auxílio da mecânica quântica e de métodos da física computacional, os cientistas do IFGW produziram simulações realísticas que ratificaram a conjectura. De acordo com Antonelli, quanto mais próximo do ponto de fusão (zero grau Celsius), maior a quantidade de moléculas intersticiais. Em outras palavras, as ligações hexagonais apresentam elementos intrusos na rede cristalina. Abaixo de 43 graus Celsius negativos, o defeito mais comum é a vacância, ou seja, a falta de uma molécula de água. “Esse mecanismo é um indício de que a matéria pode se mover dentro do cristal. Dito de outro modo, existe a possibilidade de que uma molécula ocupe o lugar da sua vizinha, como se fosse um jogo de sinuca, no qual uma bola empurra a outra”, exemplifica o docente do IFGW. Assim, um próton de hidrogênio encontra-se sempre entre dois átomos de oxigênio. Entretanto, quando submetidas a um campo elétrico, as moléculas assumem uma outra ordem. A estrutura muda e passa a ter a seguinte configuração: enquanto numa ligação aparecem dois prótons de hidrogênio entre dois átomos de oxigênio, numa outra ocorre um vazio. “As moléculas fazem um movimento de rotação”, esclarece Antonelli. Experimentalmente, esse defeito pode ser criado, por exemplo, com o acréscimo de um ácido ao gelo. Ocorre, porém, que o próprio mecanismo que gera a falha pode interferir no seu resultado. É por isso as simulações são importantes, porque permitem uma interpretação do fenômeno mais próxima do real. “Não se trata de dizer que a teoria é melhor ou mais eficiente do que o experimento prático. Os dois são importantes justamente porque se complementam”, analisa Antonelli.
Assim, um próton de hidrogênio encontra-se sempre entre dois átomos de oxigênio. Entretanto, quando submetidas a um campo elétrico, as moléculas assumem uma outra ordem. A estrutura muda e passa a ter a seguinte configuração: enquanto numa ligação aparecem dois prótons de hidrogênio entre dois átomos de oxigênio, numa outra ocorre um vazio. “As moléculas fazem um movimento de rotação”, esclarece Antonelli. Experimentalmente, esse defeito pode ser criado, por exemplo, com o acréscimo de um ácido ao gelo. Ocorre, porém, que o próprio mecanismo que gera a falha pode interferir no seu resultado. É por isso as simulações são importantes, porque permitem uma interpretação do fenômeno mais próxima do real. “Não se trata de dizer que a teoria é melhor ou mais eficiente do que o experimento prático. Os dois são importantes justamente porque se complementam”, analisa Antonelli.